深圳儿童医院袁秀丽/文飞球等研究循环肿瘤细胞及其聚集体在神经母细胞瘤诊断和预后中的价值│液体活检
液体活检(liquid biopsy)是一种通过采集体液(通常是血液,也可包括尿液、脑脊液、胸腹水等)进行分子分析,以评估疾病状态的非侵入性检测方法。它为肿瘤的早期发现、动态监测、疗效评估及耐药机制研究提供了重要工具。液体活检包括循环肿瘤细胞(CTCs,Circulating Tumor Cells),循环肿瘤DNA(ctDNA,Circulating Tumor DNA),肿瘤来源外泌体(Exosomes),循环RNA(包括miRNA, lncRNA等)以及血清或血浆蛋白标志物(如NSE, LDH等)等。随着研究的不断深入,液体活检在早期诊断、分子分型与靶向治疗指导、治疗反应监测、耐药机制探测、微小残留病灶(MRD)监测、转移或复发预警等方面发挥越来越重要的作用。
其中,循环肿瘤细胞(CTCs)作为肿瘤来源的血液中标志物,能从基因、转录、蛋白质和代谢等多个层面反映肿瘤状态。CTCs可单独存在,也可与其他肿瘤或非肿瘤细胞形成聚集体/簇(CTC clusters),后者在动物模型中表现出更强的生存和转移潜能。成人癌症中已广泛证实CTCs在肿瘤残留、疗效监测及复发预测中的价值,但儿童NB的相关临床研究仍较少。
近日,深圳儿童医院袁秀丽/文飞球和深圳市瑞格生物科技有限公司刘宗彬等在 BMC Cancer 上发表了一篇题为“Circulating tumor cells and clusters as liquid biomarkers for the diagnosis and prognosis of neuroblastoma(循环肿瘤细胞及其聚集体作为神经母细胞瘤诊断与预后的液体生物标志物)”的论文,该研究对64例新诊断的NB患者(高危40例,中危13例,低危11例)外周血中的CTC 和 CTC 聚集体进行了定性定量分析,并与20名无恶性肿瘤病史的健康儿童相关检测结果进行比较,探讨了其对NB诊断和转移预测的意义,以及 CTC 和 CTC 聚集体数量与患者临床特征之间的相关性和差异。我们来了解下。

https://doi.org/10.1186/s12885-025-14448-7
CTC和CTC聚集体检测
该研究通过微流控CFD-Chip平台对健康儿童和原发性NB患者外周血样本中的CTCs和CTC 聚集体进行检测,研究流程示意图见图1A。实验中,研究人员将NB细胞系SK-N-SH加入健康血液样本并注入芯片,CTC平均捕获效率达到87.6%(图1B),显示该方法具有良好的检测灵敏度。
免疫荧光染色结果表明,GD2和PHOX2B均为神经母细胞瘤特异性标志物,能够分别标记CTCs和CTC 聚集体(图1C和1D)。CTCs的判定标准为表达至少一个NB特异性标志物(GD2或PHOX2B)、具有完整核信号(DAPI+)、且不表达CD45;而CTC 聚集体则定义为两个或以上CTCs的聚集体。
当常规组织病理活检因肿瘤急症(如脊髓压迫或腹腔高压综合征)而无法开展时,CTC及CTC 聚集体的液体活检展现出互补的优势。结合影像学检查,CTC检测可辅助快速进行NB的初步诊断,从而使患者在病情急进阶段尽早接受风险分层的化疗,减少急诊手术相关并发症,改善治疗反应(图2A–C)。
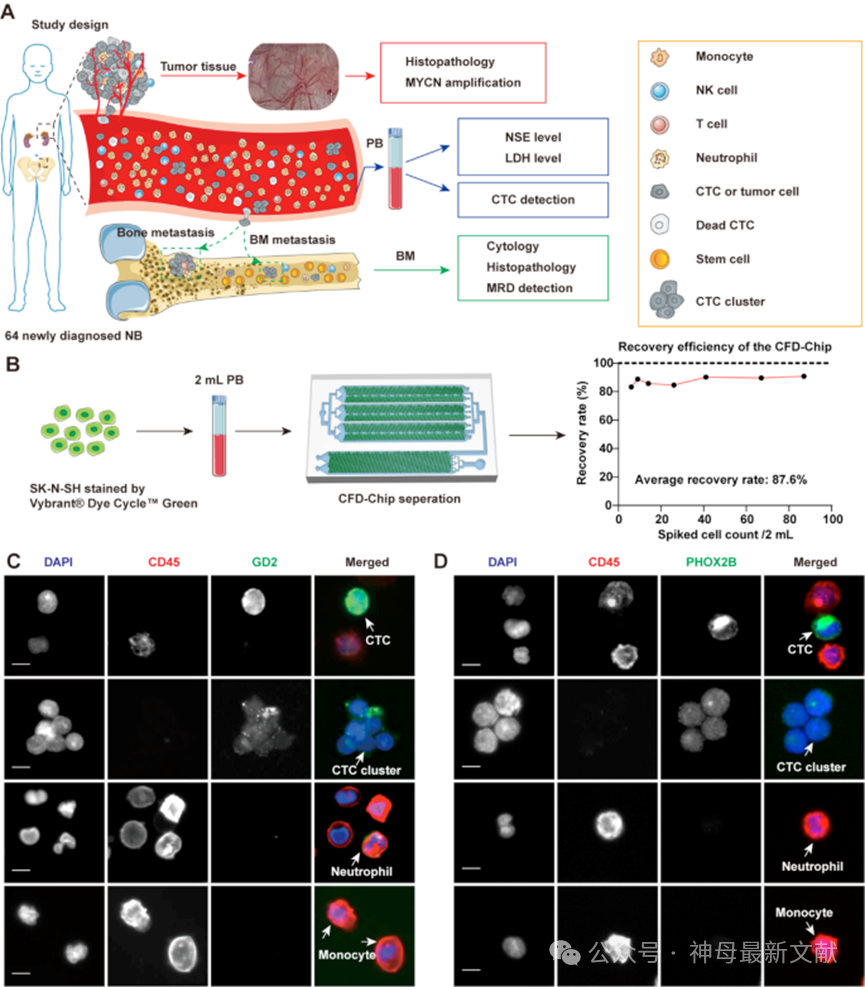
图1. 神经母细胞瘤患者循环肿瘤细胞(CTCs)及其聚集体的研究设计与免疫荧光鉴定
A,研究设计示意图。记录NB患者的临床及病理特征,并采用级联滤网式确定性侧向位移微流控芯片(CFD-Chip)富集外周血中的CTCs和CTC聚集体。
B,CFD-Chip对PB样本中SK-N-SH肿瘤细胞的捕获效率。
C–D,GD2和PHOX2B被证实为在CTCs及其聚集体中表达的NB特异性标志物。CTCs的鉴定标准包括表达至少一种NB特异性标志物(GD2或PHOX2B)、具有完整的细胞核信号以及不表达CD45。CTC聚集体定义为两个或以上CTCs的聚集结构。比例尺,10微米。
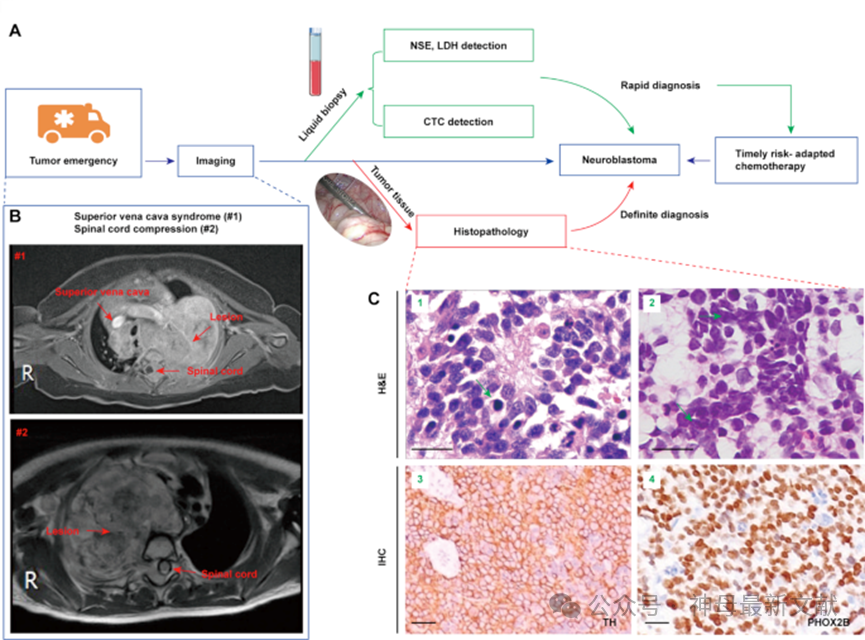
图2. CTC和CTC聚集体的检测使神经母细胞瘤急诊患者能够尽早接受风险分层的化疗
A,NB急诊治疗流程图示意。影像学检查联合CTC检测等液体活检手段可辅助快速诊断NB,而组织病理学诊断耗时较长,且在某些情况下难以实施。
B,代表性后纵隔NB急诊的MRI图像。
(#1)上腔静脉综合征:横断面脂肪抑制增强T1加权成像显示左侧后纵隔存在一大片不均匀强化肿块,病灶侵犯椎管,包绕并推动相应脊髓,跨越中线生长,累及邻近气管、食管、上腔静脉及主动脉弓。
(#2)脊髓压迫:横断面T2加权成像显示右侧后纵隔有一大片轮廓清晰的肿块影,病灶占位效应明显,邻近纵隔向左侧移位,局部病灶长入相邻椎管,压迫并移位相应脊髓。
C,通过苏木精-伊红(H&E)染色及免疫组织化学方法对NB患者进行组织病理学诊断。
(1)小圆形肿瘤细胞广泛浸润,围绕神经原纤维呈Homer-Wright玫瑰花结样排列;
(2)骨髓活检组织中可见转移性肿瘤细胞;
(3)免疫组化显示肿瘤细胞胞质TH(酪氨酸羟化酶)染色阳性;
(4)免疫组化显示肿瘤细胞胞核PHOX2B染色阳性。比例尺,50微米。
CTC和CTS聚集体用于NB早期筛查和诊断
在健康儿童中未检测到CTCs或CTC聚集体,而原发NB患者的CTCs和CTC聚集体检出率和数量均显著升高(p < 0.001)。ROC曲线分析进一步验证了CTCs和CTC 聚集体在区分健康儿童与初诊NB患者中的潜在诊断价值。
CTC和CTS聚集体计数与NB肿瘤部位和分期相关
研究还发现CTC和CTC 聚集体数量与患者的性别、年龄以及MYCN基因扩增状态无显著相关性(p > 0.05),提示CTCs可能作为一种独立于MYCN扩增状态的预后生物标志物。
然而,不同的原发肿瘤部位、风险分层、病理类型以及分期之间的CTC和CTC 聚集体数量存在显著差异。
-
原发于腹膜后区的NB患者,其CTC和CTC 聚集体数量显著高于纵隔或其他部位的NB(p = 0.0018 和 p = 0.0171),这可能部分解释了腹膜后NB预后较差的原因。
-
高危组的CTC和CTC 聚集体数量显著增加(p = 0.0038 和 p = 0.0013),表明这两项指标与高危特征密切相关。
-
神经母细胞瘤患者的CTC和CTC 聚集体数量均高于间变型神经节母细胞瘤(GNBi)、神经节瘤(GN)和节结性NB(GNBn)(p = 0.0003 和 p = 0.0157),反映其与肿瘤恶性程度相关。
-
4期患者的CTC和CTC 聚集体阳性率和数量显著高于1、2、3期(p = 0.0088 和 p = 0.0001)。
-
远处转移(M期)患者的CTC和CTC 聚集体数量也显著高于局限性L1、L2和Ms期患者(p = 0.0008 和 p < 0.0001)。
CTCs和CTC聚集体可预测转移,CTC聚集体可提示骨髓转移
研究还发现发生骨髓转移、骨转移以及任何类型远处转移的NB患者,其CTC和CTC 聚集体数量显著高于未转移患者(p < 0.001)。研究者利用ROC曲线评估了CTC和CTC 聚集体在预测骨髓转移中的诊断效能,发现其在初诊患者中具备较强的转移预测能力,尤其在无创识别骨髓转移方面展现出显著优势。
CTCs和CTC聚集体联合NSE与LDH在神经母细胞瘤诊断中的应用
NSE和LDH虽然是NB中常用的肿瘤标志物,但其特异性较低,且会受到治疗引起的细胞死亡影响。研究发现,在新诊断的NB患者中,CTCs和CTC聚集体的数量与NSE、LDH以及骨髓最小残留病灶(BM MRD)水平呈显著相关,特别是CTC聚集体与BM MRD的相关系数高达0.8089(p < 0.0001)。有趣的是,CTCs和CTC聚集体的数量与肿瘤体积无明显关联,支持肿瘤生长与转移是相对独立的过程。
OS预测
研究随访截止至2024年6月30日,中位随访时间为1131天(范围6至1900天)。64名患者中有6例死亡。死亡患者的CTC和CTC 聚集体数量显著高于存活患者(p=0.0266和p=0.0043)(图8A、C)。通过Kaplan-Meier生存曲线分析,采用5.5个CTCs/2 mL作为分界值,将患者分为CTC高组和低组,高组的死亡风险显著增加,风险比(HR)为9.503(95% CI:1.892–47.74,p=0.0063)(图8B)。同样,依据2.5个CTC 聚集体/2 mL的阈值分组,CTC 聚集体高组患者的HR为7.776(95% CI:1.457–41.51,p=0.0164)(图8D),均表明CTCs及CTC 聚集体含量较低者预后较好。
此外,对40例高危NB患者的亚组分析显示,死亡组与存活组CTC数量差异不显著,但死亡组CTC 聚集体显著更多(图8E)。死亡高危患者CTC 聚集体数量的最低值为75个/2 mL,CTC 聚集体数高于该阈值的高危患者相较于低于阈值者,死亡风险显著增加,HR达19.09(95% CI:2.976–122.4,p=0.0019)(图8F)。
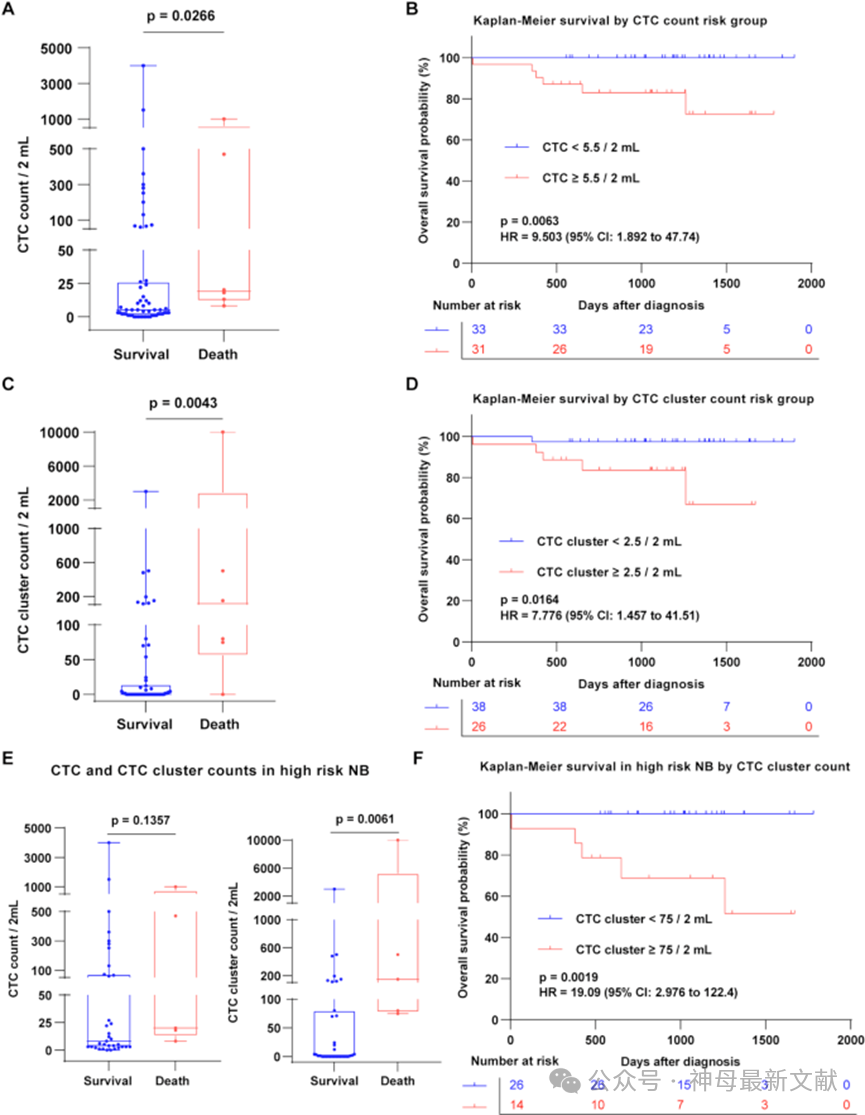
图8. CTC和CTC聚集体数量与神经母细胞瘤患者初诊时的OS相关
A,死亡患者的CTC数量显著高于存活患者。(Mann-Whitney检验,p = 0.0266)
B,CTC高组患者相比CTC低组的风险比(HR)为9.503(95% 置信区间:1.892–47.74,p = 0.0063,Log-rank检验)。
C,死亡患者的CTC聚集体数量显著高于存活患者。(Mann-Whitney检验,p = 0.0043)
D,CTC聚集体高组患者相比低组的风险比(HR)为7.776(95% 置信区间:1.457–41.51,p = 0.0164,Log-rank检验)。
E,对于高危NB患者,死亡组(5例)与存活组(35例)之间CTC数量无显著差异,但CTC聚集体数量显著较高。(Mann-Whitney检验)
F,高危患者中,2 mL外周血中CTC聚集体数量≥75的患者,相较于低于该阈值者,风险比(HR)为19.09(95% 置信区间:2.976–122.4,p = 0.0019,Log-rank检验)。
目前正在进行更长期的随访,以进一步观察患者病情发展趋势。
讨论与结论
首先,研究基于高效捕获的CFD微流控芯片技术,从新诊断NB患者外周血中分离鉴定CTCs和CTC 聚集体,未在健康儿童中检测到,显示出良好的特异性。与成人实体瘤中常用的CK和EpCAM标志物不同,NB中这些标志物表达较低,过去关于NB CTCs的研究尚处于初步阶段,且大规模临床数据匮乏。本研究是迄今为止规模最大的NB CTC及CTC聚集体检测报告,首次系统揭示了CTC聚集体在NB诊断和预后中的临床价值。
其次,研究显示CTCs和CTC聚集体在NB诊断中具备较高的灵敏度和特异性,尤其对于难以活检的原发肿瘤部位尤为重要。CTC及其聚集体数量在不同原发部位及风险分层中存在显著差异,且与骨髓转移和整体转移密切相关,特别是腹膜后NB表现出更高的CTC及CTC聚集体数量,解释了其较差预后。
此外,CTC聚集体的存在与骨髓转移显著相关,对于难以进行侵入性骨髓穿刺的急诊患者,液体活检提供了无创、实时的疾病状态评估手段。CTC检测还可用于最小残留病灶和早期复发的动态监测,并有望作为GD2阳性患者分层和靶向治疗的标志物,推动精准医疗的发展。
值得注意的是,CTCs及CTC聚集体数量与肿瘤体积无显著相关,支持转移与肿瘤生长为相对独立过程的观点,提示靶向转移机制的新思路。
最后,CTCs及CTC聚集体与传统血清标志物NSE、LDH及骨髓MRD呈显著相关,联合应用显著提升骨髓及全身转移的诊断准确性。同时,CTCs≥5.5/2 mL或CTC聚集体≥2.5/2 mL与较差的总体生存显著相关,高危患者CTC聚集体≥75/2 mL更需严密监控。
结论:CTCs和CTC聚集体作为NB的重要无创生物标志物,不仅反映肿瘤的临床和病理特征,还为早期诊断、风险分层、转移预测及治疗监测提供了有力工具,未来有望促进NB精准诊疗和新靶点的发现。
相关推荐
您可能也感兴趣…
-
Date2025.07.07深圳儿童医院袁秀丽/文飞球等研究循环肿瘤细胞及其聚集体在神经母细胞瘤诊断和预后中的价值│液体活检
瑞格登上国际权威期刊---《BMC Cancer》
64例NB患儿研究,系统分析CTC与CTC簇的临床价值
了解详情 -
Date2025.07.012025神经母细胞瘤前沿论坛圆满收官 聚焦分子免疫诊疗,瑞格生物CIC研究成果成亮点
瑞格生物刘宗彬博士天津论坛分享神母诊疗新突破.
了解详情 -
Date2025.06.23瑞格生物携手新乡医学院第一附属医院蝉联CGCS峰会双奖
瑞格生物携手新乡医学院第一附属医院蝉联CGCS峰会双奖
(微流控芯片技术推动肿瘤精准诊断新突破)
了解详情
